Rappels
Examen de médecine nucléaire permettant l’acquisition et la fusion d’images scannographiques et scintigraphiques
- Apport d’information anatomique et fonctionnelle
Couronne de détecteurs : permet de voir les annihilations (gamma de 511 KeV) : disparition de la matière et création d’énergie
Ordinateur : unité de processing, de coïncidence
Si les deux rayonnements n’arrivent pas à un temps <2ns ils ne seront pas pris en comptes
Utilisation d’isotopes émetteurs de positons ou particules B+
Le plus utilisé est le 18F
Synthèse de l’isotope dans un cyclotron médical
Protocole TEP au FDG
Indications
Buts :
- Faire le diagnostic initial : recherche d’une tumeur primitive et de faire le bilan d’éventuelles localisations secondaires ou ganglionnaires.
- Stadification et éventuelle modification de la prise en charge initiale.
- Evaluation précoce de l’efficacité de la chimiothérapie et détection d’une éventuelle récidive.
Cardiologie : indentification des patients susceptibles de bénéficier d’une revascularisation du myocarde après infarctus
Neurologie :
- Evaluation des patients épileptiques susceptibles de bénéficier d’une chirurgie
- Aide au diagnostic précoce des maladies neuro-dégénératives
Oncologie :
- Cancer broncho-pulmonaires
- Lymphomes LH et LNH
- Cancer du sein, des ovaires
- Cancers colorectaux, œsophage, pancréas
- Cancer testiculaires
- Cancer du rein
- Sarcomes
- Cancer ORL
- Mélanomes et tumeurs cutanées
Autres :
- Pathologies tumorales bénignes
- Viabilité myocarde après infarctus
- Vascularites, sarcoïdose
- Fièvre au long cours
- Myélome
- Syndrome para-néoplasique
- Maladies inflammatoires : PR, RCH, maladie de Crohn
- Fibroses pulmonaires
Contre-indications
Grossesse
Réalisations d’un examen
Informations souhaitables pour un examen de qualité
Motifs de l’examen
Résultats des derniers examens (biologique, radiologique, clinique, endoscopie et éventuelle biopsie)
Date de dernière chimiothérapie : délai de 1mois (mais peut réalisable)
Date de dernière radiothérapie : délai de 4 mois (si on veut regarder la zone irradiée)
Date de chirurgie : délai de 6 semaines (sauf si zone à étudier différent que la zone de chirurgie)
Diabète :
- Si glycémie trop élevée, mauvaise fixation
- Soit diabétique non ID : à jeun 6h avant, bien prendre le traitement
- Soit diabétique ID : repas, et insuline normalement, avoir un minimum de 4h entre insuline et examen
Infection
- Risque d’hyperfixation dans la zone
- Le patient risque de bouger, tousser
Informations et préparation du patient
3 types de patient :
- A jeun 6h avant examen, médicaments habituelles
- Si diabétique non insulino dépendant : à jeun 6h avant et surtout prendre son comprimé pour le diabète
- Si diabétique insulino dépendant : prendre un repas léger et faire son insuline
Peuvent boire de l’eau autant qu’ils veulent et peuvent prendre leurs médicaments
Mise au repos 20min après avoir posé une perfusion de chlorure de sodium 0,9%
Injection du radiopharmaceutique
Repos strict sans bouger, sans lire, et sans parler pendant 45min à 1h
Retirer la perfusion, faire vider la vessie avant acquisition des images
Retirer objets métalliques
Précautions
Femme en âge de procréer : absence de grossesse (Date des dernières règles : fixation différente au niveau de l’utérus ; contraceptifs ?)
Eviter contact prolongé femmes enceintes et enfants de moins de 3ans pendant 1h
Allaitement :
- Tirer le lait avant pour le donner le lendemain
- Après injection tirer le lait et le jeter pendant délai de 12h
- Reprise de l’allaitement au-delà de 12h
Enfant : réduction de la dose au minimum
Le radiopharmaceutique
Caractéristiques physiques :
- Emissions : B+ et gamma
- Energies : 633 KeV et 2×511 KeV
- Période : 109,8 minutes
Caractéristiques du FDG (Fluoro-2-desoxy-D-Glucose) :
Analogue du Glucose marqué au fluor 18
Métabolisme et captation :
Métabolisme glucidique cellulaire dans la cellule normale :
- Captation par transmetteur
- Transformation en Glucose-6-phosphate grâce à l’héxokinase
- Nombreuses réactions chimiques pour aboutir à la production d’ATP qui va réguler la glycolyse
Métabolisme glucidique cellulaire dans la cellule tumorale :
- Captation par transmetteur
- Augmentation de l’activité de l’héxokinase
- La glycolyse est accélérée
- Plus de rétrocontrôle dans les cellules tumorales indiquant que la cellule à trop de glucose
Captation cellulaire du FDG :
- Analogue du glucose
- Capté par la cellulaire comme le glucose
- Transformation en fluoro-2-DG-6-phosphate grâce à l’héxokinase
- Accumulation normale
Captation cellulaire du FDG :
- Dans une cellule tumorale cette molécule ne peut être métabolisée par aucune enzyme
- Piégé dans la cellule
- Accumulation excessive
Préparation du radiopharmaceutique :
- Dans un cyclotron
- Prêt à l’emploi
- Solution injectable stérile
- En multidoses ou en monodose
Préparation
- Prélèvement manuelle
- Prélèvement semi-automatique
Activité injectée :
- 150 à 550 MBq (2 à 6 MBq/kg)
- Fonction de l’IMC
Intervention
Prémédication : (dépend des patients)
- Patients anxieux : myorelaxant comme ATARAX
- Bétabloquant : limitation de la fixation de la graisse brune
- Diurétique pour cancer abdomino-pelvien
Acquisition des images
Séquences d’imageries
Examen de base :
- Positionnement : décubitus dorsal bras en l’air
- Topogramme :
- Du haut du crâne jusqu’au tiers supérieurs des fémurs
- Positionnement des « pas » TEP
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Pitch : 1,4
- 120 kV et 120mAs
- Care dose et care kV
TEP : fonction de la taille et de son IMC (entre 90 s/pas pour IMC <20 et 210s/pas pour IMC > 28
Examen ORL :
- Positionnement : décubitus dorsal bras le long du corps tête calé dans la têtière
- Topogramme : positionnement sus ou sous orbitaire
Scanner :
- 150mAs et 120 kV
- Coupe de 3mm incrément de reconstruction 1,5mm
- Pitch 0,8
TEP :
- 1 à 2 pas de 10 minutes
- Reconstruction fine
Examen abdomino-pelvien :
- Positionnement : décubitus dorsal bras en l’air
- Topogramme :
- Positionnement des « pas » TEP : de foie vessie ou reins à vessie ou petit bassin
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Pitch 1,4
- 120 kV et 120 mAs
- Care dose et care kV
Tep :
- Fonction de la taille et de son IMC (150s/pas)
Examens corps entier (mélanome)
- Positionnement : décubitus dorsal bras le long du corps
- Topogramme :
- Du haut du crane jusqu’aux pieds
- Positionnement des « pas » TEP
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Pitch : 1,4
- 120kV et 120mAs
- Care dose et care kV
TEP :
- Fonction de la taille et de son IMC (entre 90s/pas et 210s/pas) et diminution sur les jambes à 90s/pas
Examen thorax avec synchronisation respiratoire :
- Positionnement : décubitus dorsal bras en l’air
- Centrage sur le thorax
- Getting : blocs de deux détecteurs et image infrarouge
Traitement des images :
- Visualisation des images corrigées de l’atténuation :
- Apport : meilleure visualisation des structures profondes (rachis) et facilite la localisation des différentes lésions
- Limites : artéfacts, en particulier dans les zones de changement rapide du coefficient d’atténuation, donc au voisinage du diaphragme et au niveau de la face.
Traitement des images
Calcul du SUV : standardized uptake value – valeur de captation normalisée :
Rapport de fixation dans un tissu d’intérêt (kBq/ml) à un instant donné par rapport à la dose injectée au patient (kBq) et son volume (ml) :

SUV index utile
Méthode d’acquisition de traitement d’images doivent suivre le même protocole et être reproductibles
Permet de comparer l’intensité de fixation du FDG au sein de la tumeur entre les différents patients ou à différent stade de la prise en charge thérapeutique pour le même patient
En pratique SUV > 2,5 territoire franchement pathologique
Interprétation des images
Aspect normal d’une scintigraphie au 18FDG :
Fixations physiologiques :
- Cerveau
- Elimination urinaire :
- Reins
- Uretères
- Vessie
- Tubes digestifs
- Thymus chez les enfants
Aspect du tissu néoplasique sur la scintigraphie au 18FDG :
Fixations pathologiques :
- Cancer primaire
- Métastases
- Lymphomes
Comparaison ou fusion des images de diverses modalités
L’examen au 18F FDG est plus sensible et plus spécifique que la radiologie conventionnelle mais est pauvre en repère anatomique :
- Couplage d’un TEP avec scanner ou IRM
- Scanner : image morphologique
- TEP : image fonctionnelle
Images de fusion
Artefacts et sources d’erreurs
Artefacts
Artéfact le plus fréquent : zone d’hypofixation en forme d’étoiles au voisinage des organes les plus actifs ou des implants métalliques si la TDM est utilisée pour la correction de l’atténuation.
Faux négatifs (répondu négatif, mais cancer malin)
Taille lésion < seuil de détection de la machine
Avidité de la tumeur pour le traceur :
- Activité métabolique variable ou croissance lente
- Nécrotique, peu ou mal vascularisée
- Métabolique glucidique présentant caractéristiques particulières (hépato-carcinome)
Localisation de la tumeur (vessie)
Déséquilibre majeur de la glycémie du patient
Faux positifs (fixation anormale mais pas de tumeurs malignes)
Fixations physiologiques : muscle, graisse brune, gastrique, stases urétérales…
Fixations thymiques
Follicules ovariens et formations utérines, menstruations
Cancers bénins avec hypermétabolisme glucidique : infection fongique, tuberculose, sarcoïdose…
Inflammation ou infection
Cicatrice chirurgicale récente
Précautions de radioprotection
Gestion des déchets
L’aiguille d’injection ou cathéter : élimination dans un récupérateur d’aiguilles dans les boites plombées.
L’éventuel perfusion : élimination dans fût blindé (matériel biologiquement contaminé).
Les flacons et les seringues : stockage jusqu’à une valeur autorisant leur élimination.
Vis-à-vis du personnel soignant et de la famille du patient
Personnel : utilisation, pour le stockage, les manipulations et les comptages de la solution de 18f FDG, une enceinte blindée spécifique et des protège-seringues eux aussi adaptés aux radionucléides émetteurs de positons (tungstène).
Famille du patient : Une fois le patient injecté, évité de rester à proximité immédiate du patient.
Une fois l’examen fini (environ 2 à 3h après l’administration), le patient est faiblement irradiant.
Urines, selles et prélèvements sanguins
Les urines et les selles : dans les toilettes.
Les garnitures, sondes urinaires, bocaux : manipulation avec des gants.
Patients hospitalisés : collecter les déchets solides durant 12h et de les conserver durant 24h.
Protocole TEP à la choline
Informations et définitions préalables
La choline est un composant lipidique des membranes cellulaires
L’activité métabolique est augmentée dans un grand nombre de tumeurs malignes humaines (notamment prostatique, mammaire, ovarienne, colique et pulmonaire) aboutissant à une augmentation de la concentration intracellulaire de la choline et de ses dérivés
Fluorocholine : le fluorométhyl-18F-diméthyl-2hydroxyméthyl-ammonium.
Choline :
- Substrat extrinsèque à la phosphatidylcholine, précurseur des phospholipides membranaires
- Incorporation aux phospholipides via la choline kinase par phosphorylation :
- Traverse la membrane cellulaire grâce à un transporteur
- Phosphorylée par la choline kinase
- Phosphorylcholine incorporée dans la phophatidylcholine (composant de la membrane cellulaire)
- Le métabolisme de la fluorocholine est identique à celui de la choline pour ces étapes
En cas de tumeur :
- Augmentation du transporteur cellulaire
- Augmentation de la phosphorylation de la choline, avec augmentation de l’expression de choline kinase
Indications
Cancer prostatique :
Détection des lésions métastatiques du cancer de la prostate en vue de changement de traitement.
Carcinome hépatocellulaire :
Caractérisation de nodule hépatique et/ou recherche de CHC lorsque la TEP FDG n’est pas concluante.
Bilan pré opératoire du CHC notamment lorsque une greffe est prévu.
Contre-indications
- Grossesse
- Hypersensibilité à la substance active ou à l’un des excipients
Réalisations d’un examen
Informations souhaitables pour un examen de qualité
Motifs de l’examen
Résultats des derniers examens (biologique, radiologique, clinique, TEP/TDM au 18F-FDG ou au 18FFNa, IRM, endoscopie, éventuelle biopsie (résultats anatomopathologistes))
Antécédents thérapeutiques et traitements actuels
S’assurer que le patient soit capable de rester allongé pendant la durée prévisible de l’examen (de 20 à 30min selon les machines) sans tousser, sans bouger, bras au-dessus de la tête.
Informations et préparation du patient
A jeun 4h avant l’examen
Doit boire de l’eau avant l’examen et peuvent prendre leur médicaments
Pas besoin de mise au repos après avoir posé une perfusion de chlorure de sodium 0,9%
Cancer de prostate : injection du radiopharmaceutique en dynamique
Carcinome hépatocellulaire : injection du radiopharmaceutique dans le box e image 5 à 10min post IV
Pas de repos
Précautions
Femme en âge de procréer : absence de grossesse (Date des dernières règles : fixation différente au niveau de l’utérus ; contraceptifs ?)
Eviter contact prolongé femmes enceintes et enfants de moins de 3ans pendant 12h
Allaitement :
- Tirer le lait avant pour le donner le lendemain
- Après injection tirer le lait et le jeter pendant délai de 12h
- Reprise de l’allaitement au-delà de 12h
Enfant : fluorocholine non recommandé en oncologie pédiatrique
Interactions médicamenteuses :
L’indication d’une Tep à la FCH doit être particulièrement étudiée chez les patients qui reçoivent un traitement anti-androgénique ou une chimiothérapie. Tout changement récent dans le traitement doit conduire à revoir l’indication d’une TEP à la FCH.
Effets secondaires : aucun effet indésirable sérieux n’a été décrit à ce jour
Conservation : 14h à compter de l’heur de fabrication
Le radiopharmaceutique
Caractéristiques physiques :
- Emissions : B+ et gamma
- Energies : 633 KeV et 2×511 KeV
- Période : 109,8 minutes
Préparation du radiopharmaceutique :
Dans un cyclotron
Prêt à l’emploi
Solution injectable stérile
En multidoses ou en monodose de 15ml en verre, fermé par un bouchon en caoutchouc recouvert de téflon et scellé par une capsule en aluminium.
Activité injectée :
- 4 à 5 MBq/kg chez l’adult
Conservation :
IASOCHOLINE® :
- Pas de conservateurs
- Conservation à température ambiante (inférieure à 25°C) dans son conditionnement d’origine pendant 14h à compter de l’heure de production et 8h après la première utilisation sans dépasser l’heure d’expiration
Préparation du radiopharmaceutique :
Manuelle
Intervention
Prémédication : non
Acquisition des images
Séquences d’imageries
Examen dynamique centré sur la loge de la prostate
- Faire enlever tous vêtements, métal ou bijoux appareil dentaire ou auditif
- Positionnement : décubitus dorsal bras en l’air tête à l’intérieur de l’anneau
- Topogramme :
- Bassin
- Un pas centré sur la loge prostatique
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Care dose et care kV
TEP : 4 images TEP de 2min avec 1 seul pas centré sur la loge prostatique
Examen corps entier :
- Positionnement : décubitus dorsal bras en l’air
- Topogramme :
- Haut du crâne jusqu’au tiers supérieurs des fémurs
- Positionnement des « pas » TEP
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Pitch : 1,4
- 120 kV et 120mAs
- Care dose et care kV
TEP : fonction de la taille et de son IMC (entre 180s/pas (maigre) et 210 s/pas (fort))
+/- Examen abdomino-pelvien avec injection de Lasilix :
- Positionnemen,t : décubitus dorsal bras en l’air
- Topogramme
- Positionnement des « pas » Tep
- De foie vessie ou reins à vessie ou petite bassin
Scanner :
- Carte d’atténuation coupes épaisses
- Interprétation : coupes fines
- Pitch : 1,4
- 120kV et 120mAs
- Care dose et care kV
TEP : fonction de la taille et de son IMC (210s/pas)
Traitements des images
Calcul du SUV : standardized uptake value – valeur de captation normalisée :
Rapport de fixation dans un tissu d’intérêt (kBq/ml) à un instant donné par rapport à la dose injectée au patient (kBq) et son volume (ml) :

SUV index utile
Méthode d’acquisition de traitement d’images doivent suivre le même protocole et être reproductibles
Permet de comparer l’intensité de fixation de la choline au sein de la tumeur entre les différents patients ou à différent stade de la prise en charge thérapeutique pour le même patient
Interprétation des images
Aspect normal d’une scintigraphie au 18F-choline :
Fixations physiologiques :
- Glandes salivaires et lacrymales
- Moelle osseuse
- Foie rate pancréas
- Glandes surrénales
- Reins (cortex + urine)
- Digestif
- Urine
Aspect du tissu néoplasique sur la scintigraphie au 18F-choline :
Fixations pathologiques :
- Cancer primaire prostate
- Métastases osseuses
- Ganglions hypermétaboliques
Interprétations des images
La fixation de la FCH par les foyers tumoraux débute immédiatement après injection, alors que l’élimination de la FCH dans les voies urinaires commence vers la quatrième minute
L’acquisition d’images dynamiques précoces (immédiatement après injection comme décrit précédemment) permet donc une analyse de la région pelvienne avant l’apparition de l’urine radioactive.
L’interprétation est facilitée, et la spécificité est améliorée, par la lecture des images de la TDM et des images de fusion TEP/TDM.
Les images TEP non corrigées de l’atténuation doivent également être prises en compte, en particulier au voisinage des structures métalliques (prothèses).
Artefacts et sources d’erreurs
Artefacts
Artéfact le plus fréquent : la radioactivité des urines, dans les cas de dilatation, de stase ou de malposition des voies urinaires en particulier après chirurgie urologique, ou à des contaminations cutanées lors de mictions.
Faux positifs
Inflammation comme une prostatite ou pneumopathie
Hyperfixations hépatiques de la FCH en rapport avec des hyperplasies nodulaires focales (HNF) ou des adénomes hépatocellulaires (AHC)
La FCH n’est pas spécifique de l’adénocarcinome prostatique et du CHC et de nombreux autres néoplasies présentent une hyperfixation du traceur (pulmonaire, mammaire, cérébrale…)
- Fixation ganglionnaire intense sur les images dynamiques précoces qui s’atténue nettement sur les images « corps entier » acquises entre 10-20min après l’injection orientera plutôt vers une fixation d’origine inflammatoire néoplasique
- Adénopathies malignes : la fixation restera relativement stable dans le temps
Précautions de radioprotection
Gestion des déchets
L’aiguille d’injection ou cathéter : élimination dans un récupérateur d’aiguilles dans les boites plombées.
L’éventuel perfusion : élimination dans fût blindé (matériel biologiquement contaminé).
Les flacons et les seringues : stockage jusqu’à une valeur autorisant leur élimination.
Vis-à-vis du personnel soignant et de la famille du patient
Personnel : utilisation, pour le stockage, les manipulations et les comptages de la solution de 18F-choline, une enceinte blindée spécifique et des protège-seringues eux aussi adaptés aux radionucléides émetteurs de positons (tungstène).
Famille du patient : Une fois le patient injecté, évité de rester à proximité immédiate du patient.
Une fois l’examen fini (environ 2 à 3h après l’administration), le patient est faiblement irradiant.
Urines, selles et prélèvements sanguins
Les urines et les selles : dans les toilettes.
Les garnitures, sondes urinaires, bocaux : manipulation avec des gants.
Patients hospitalisés : collecter les déchets solides durant 12h et de les conserver durant 24h.
Protocole TEP à la F-DOPA
Informations et définitions préalables
La 6-fluoro-(18F)-L-DOPA est un analogue de la dihydroxyphénylalanine (DOPA), acide aminé aromatique rapidement accumulé par les tissus cibles (en particulier le striatum du cerveau humain) et transformé en dopamine, neurotransmetteur de la famille des catécholamines.
Indications
Neurologie
Diagnostic différentiel de la maladie de Parkinson au sein des syndromes extrapyramidaux
Hyperinsulinisme congénital
Oncologie :
- Tumeurs cérébrales primitives
- Phéochromocytomes et paragangliomes négatif mIBG® (localisation, stadification, récidive)
- Cancer médullaire de la thyroïde avec élévation de la calcitonine sérique
- Tumeurs carcinoïdes bien différentiées du tube digestif
- Autres tumeurs endocrines digestives, Octréoscan® négatif
Contre-indications
Grossesse
Réalisations d’un examen
Informations souhaitables pour un examen de qualité
Motifs de l’examen
Résultats des derniers examens (biologique (évolution de la concentration circulante des marqueurs tumoraux), radiologique, clinique, IRM, endoscopie, éventuelle biopsie).
Antécédents thérapeutiques et traitements actuels.
S’assurer que le patient soit capable de rester allongé pendant la durée prévisible de l’examen (de 20 à 30min selon les machines) sans tousser, sans bouger, bras au-dessus de la tête.
Informations et préparation du patient
A jeun 4h avant l’examen
Doit boire de l’eau avant l’examen et peuvent prendre leur médicaments sauf en cas de maladie de parkinson où on arrête les médicaments pendant 12h avant examen.
Un jeûn protéique est requis pour éviter la compétition éventuelle entre les acides aminés apportés par l’alimentation et l’acide aminé administré
Par contre, aucune restriction en glucides n’est indiquée en particulier chez les patients adressés pour recherche étiologique d’un hyperinsulinisme. Dans ce cas, les apports glucosés per os ou par voie intraveineuse sont autorisés.
De même, il n’a pas été rapporté d’incidence d’un diabète sucré mal équilibré sur la qualité de l’examen. A noter que pour le diagnostic d’un hyperinsulinisme néo-natal, il est conseillé de perfuser l’enfant en glucose.
Précautions
Femme en âge de procréer : absence de grossesse (Date des dernières règles : fixation différente au niveau de l’utérus ; contraceptifs ?)
Eviter contact prolongé femmes enceintes et enfants de moins de 3ans pendant 12h
Allaitement :
- Tirer le lait avant pour le donner le lendemain
- Après injection tirer le lait et le jeter pendant délai de 12h
- Reprise de l’allaitement au-delà de 12h
Interactions médicamenteuses :
Médicaments à arrêter :
- Carbidopa
- Inhibiteurs de MAO (mono-amine-oxydase)
- Halopéridol
- Réserpine
Effets secondaires : aucun effet indésirable sérieux n’a été décrit à ce jour
Conservation :
- Ne pas dépasser la date et l’heure limite d’utilisation
- Conservation à l’intérieur de sa protection en plomb du fait de l’énergie des photons émis, même à l’intérieure de l’enceinte blindée (Boite à gants)
Le radiopharmaceutique
Caractéristiques physiques :
- Emissions : B+ et gamma
- Energies : 633 KeV et 2×511 KeV
- Période : 109,8 minutes
Préparation du radiopharmaceutique :
Dans un cyclotron
Prêt à l’emploi
Solution injectable stérile 6-fluoro-18F-L-Dopa
En flacon multidoses ou en monodose
Solution de 18F-DOPA doit être limpide, incolore ou jaune pâle et sans particule visible
Activité injectée :
- 4 MBq/kg chez l’adulte en IV lente
- 2 MBq/kg pour indication neurologique
- Pour enfant utilisation d’abaque en fonction du poids
Conservation :
- Pas de conservateurs
- Conservation à température ambiante (inférieure à 25°C) dans son conditionnement d’origine jusqu’à date et heure de préemption et après la première utilisation mettre au réfrigérateur
Préparation du radiopharmaceutique :
Manuelle
Intervention
Prémédication :
Administration de 100 à 200mg de Carbidopa une heure à une heure et demie avant l’injection de 6-fluoro-18F-L-DOPA (avec adaptation de la posologie chez l’enfant) est une pratique reconnue pour les indications neurologiques mais moins fréquente dans les indications oncologiques
Acquisition des images
Séquences d’imageries
Neurologie (hors neuro-oncologie) :
- L’acquisition cérébrale peut être réalisée :
- Soit en mode dynamique, l’acquisition pourra se faire dès la fin de l’injection du radiopharmaceutique durant une période de 90 à 120min en fonction de la courbe cinétique que l’on va étudier
- Soit en mode statique, 90min après l’injection du médicament radiopharmaceutique
Neuro-oncologie :
- L’acquisition cérébrale peut être réalisée :
- Soit en mode dynamique, durant une période de 30 à 45 minutes après l’injection
- Soit en mode statique entre la 10ème et la 30ème minutes après l’injection
Oncologie (hors tumeurs cérébrales)
Les paramètres d’acquisition TDM doivent être optimisés dans le cadre d’un compromis entre qualité d’images souhaitée et radioprotection du patient, en particulier chez l’enfant
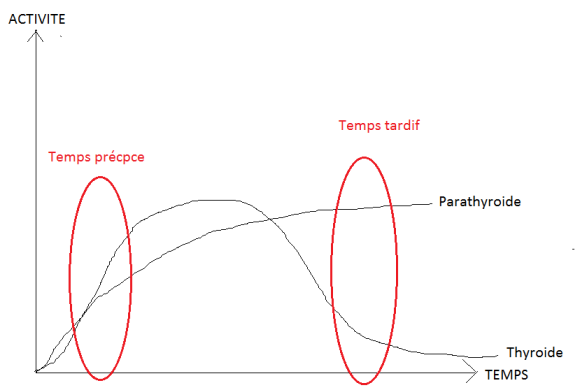
Examen ORL (temps précoce) :
- Faire enlever tous vêtements, métal ou bijoux appareil dentaire ou auditif
- Positionnement : décubitus dorsal bras le long du corps tête calé dans la tétière
- Topogramme :
- Positionnement de 2 pas sous orbitaire
Scanner :
- 150mAs 120kV
- Coupe de 3mm, incrément de reconstruction 1,5mm, pitch 0,8
TEP : 1 à 2 pas de10min. Reconstruction plus fine.
Examen standard (temps tardif) : 60min à 90min post IV avec repos en box entre image précoce et tardif.
Examen abdominal (temps précoce) : 5min post Iv (intervient avant l’élimination biliodigestive physiologique et aide à l’interprétation des images réalisées une heure après l’injection)
- Positionnement : décubitus dorsal bras en l’air
- Topogramme :
- Positionnement de 2 à 3 « pas » en commençant par le foie
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Pitch : 1,4
- 120 kV et 120mAs
- Care dose et care kV
TEP : 2 à 3 pas de 5min. reconstruction plsu fine. Changer l’orientation pour commencer par le foie.
Examen standard (temps tardif) : 60min à 90min post IV après injection en box
Examen de base tardif :
- Positionnement : décubitus dorsal bras en l’air
- Topogramme :
- Du haut du crane jusqu’au tiers supérieurs des fémurs
- Positinnement des « pas » du TEP
Scanner :
- Carte d’atténuation : coupes épaisses
- Interprétation : coupes fines
- Pitch : 1,4
- 120 kV et 120mAs
- Care dose et care kV
TEP : fonction de la taille et de l’IMC
Traitements des images
Calcul du SUV : standardized uptake value – valeur de captation normalisée :
Rapport de fixation dans un tissu d’intérêt (kBq/ml) à un instant donné par rapport à la dose injectée au patient (kBq) et son volume (ml) :

SUV index utile
Méthode d’acquisition de traitement d’images doivent suivre le même protocole et être reproductibles
Permet de comparer l’intensité de fixation de la choline au sein de la tumeur entre les différents patients ou à différent stade de la prise en charge thérapeutique pour le même patient
Interprétation des images
Aspect normal d’une scintigraphie au 18F-FDOPA :
Fixations physiologiques :
- Au sein des striatums
- Des voies biliaires, plus particulièrement au niveau de la vésicule biliaire
- Du foie de manière modérée
- Du pancréas
- Du duodénum
- Des reins et des voies urinaires
- Des surrénales de manières modérée
Artefacts et sources d’erreurs
Artefacts
L’élimination biliodigestive et la fixation physiologique pancréatique souvent hétérogène, peuvent être une source d’erreurs.
La comparaison des temps précoce et tardifs est une aide à l’interruption. Elle permet de détecter d’éventuels foyers tumoraux qui pourraient passer inaperçus sur l’acquisition tardive, masquée par ces fixations physiologiques ou bien ayant authentiquement disparu au temps tardif.
Précautions de radioprotection
Gestion des déchets
L’aiguille d’injection ou cathéter : élimination dans un récupérateur d’aiguilles dans les boites plombées.
L’éventuel perfusion : élimination dans fût blindé (matériel biologiquement contaminé).
Les flacons et les seringues : stockage jusqu’à une valeur autorisant leur élimination.
Vis-à-vis du personnel soignant et de la famille du patient
Personnel : utilisation, pour le stockage, les manipulations et les comptages de la solution de 18F-FDOPA, une enceinte blindée spécifique et des protège-seringues eux aussi adaptés aux radionucléides émetteurs de positons (tungstène).
Famille du patient : Une fois le patient injecté, évité de rester à proximité immédiate du patient.
Une fois l’examen fini (environ 2 à 3h après l’administration), le patient est faiblement irradiant.
Urines, selles et prélèvements sanguins
Les urines et les selles : dans les toilettes.
Les garnitures, sondes urinaires, bocaux : manipulation avec des gants.
Patients hospitalisés : collecter les déchets solides durant 12h et de les conserver durant 24h.