HYPOPHYSE
- Description
L’hypophyse, aussi couramment appelée la glande pituitaire. Elle est rattachée à l’hypothalamus par une petite tige verticale que l’on l’appelle la tige pituitaire.
C’est une structure mixte, à la fois glandulaire et nerveuse :
- La partie antérieur s’appelle l’Antéhypophyse ou Adénohypophyse. Elle est de nature glandulaire et produit essentiellement des hormones.
- La partie postérieur, s’appelle la Posthypophyse ou Neurohypophyse.
L’hypophyse sécrète différentes hormones :
- la GH, hormone de croissance qui stimule les tissus et le métabolisme énergétique
- l’ACTH, hormone adrénocorticotrope qui agit sur les glandes surrénales en stimulant leur production de corticostéroïdes
- la TSH, hormone thyréotrope qui agit sur la glande thyroïde
- la prolactine qui agit sur les glandes mammaires en stimulant leur production de lait.
- la FSH (folliculine) et la LH (hormone lutéinisante) qui agissent sur les organes reproducteurs. Elles stimulent la reproduction et la sécrétion des hormones sexuelles.
- la MSH, mélatonine qui contrôle la pigmentation de la peau.
- l’ADH, hormone antidiurétique, appelée vasopressine, qui contrôle le volume d’urine sécrétée.
- l’ocytocine qui stimule les contractions de l’utérus et la sécrétion de lait des glandes mammaires.
Examen
Préparation du patient :
- Récupération de la demande d’examen
- Récupération des prises de sang récentes avec les dosages hormonaux
- Analyse clinique
- Pose de VVP ( voie veineuse périphérique ).
Toujours référer du cas avec le radiologue –à-à Protocole peut être différent
Dans quel cas je fais une IRM Hypophysaire ?
Syndrome Tumoral :
- Altération du champs visuel
- Diplopie
- Céphalées
- Apoplexie hypophysaire = Hémorragie d’un adénome
Syndrome Hormonal :
- Perturbation d’une ou plusieurs hormones contrôlés par l’hypophyse
- Aménorrhée-galactorrhée
- Impuissance
- Faciès cushingoïde
- Acromégalie,
- Diabète insipide
Post opératoire : Surveillance d’une exérèse totale ou partielle
Protocole : Affiné pour chaque pathologie ensuite
Base Commune :
- SAG T1
- CORO T1 SE FIN
- CORO T2 SE FIN
Injection
- soit CORO T1 DYNAMIQUE GADO + CORO T1 GADO
- soit CORO T1 GADO ou 3D T1 GADO EG ++++
Attention injection de moitié ou ¾ de la dose normale afin de ne pas noyer un adénome.
Possibilité de rajouter un AX T1 SE FIN pour l’étude de la Post Hypophyse
Possibilité de rajouter un AX FLAIR si Macro adénome , envahissement….
PATHOLOGIE
Adénome hypophysaire représente 90 % des pathologies de l’hypophyse
Le reste se partage entre :
- Craniopharyngiome
- Méningiome
- Kyste de la poche de Rathke
- Gliome
- Chordome
- Métastases
Savoir Lire et comprendre un compte rendu
Les pathologies Hypophysaires sont souvent décrites suivant plusieurs critères
TAILLE
- Picoadénome hypophysaire: ø <3mm
- Microacénome : 3-10 mm
- Macroadénome: ø >10 mm
LOCALISATION
- Antérieur, postérieur , latéral ….. au sein de la glande
SUR LE PLAN HORMONAL
- Adénome sécrétant: 75 % des cas
- Adénome non sécrétant: 25% des cas
EXTENSION
On se fixe toujours par rapport à la scelle turcique
- SUPRA SELLAIRE
- INTRA SELLAIRE
- LATERO SELLAIRE
LES ADENOMES
Un adénome est une tumeur bénigne pouvant affecter une glande ou bien une muqueuse.
2 types :
- ADENOMES SECRETANT = Perturbation hormonal (75 % des adénomes)
- ADENOMES NON SECRETANT = 25 % des adénomes
Les adénomes sécrétant
PROLACTINOME ( 40 %)
Clinique :
- Chez la femme : aménorrhée, galactorrhée , Stérilité , troubles de la libido
- Chez l’homme: troubles de l’érection, Galactorrhée, syndrome tumoral
Biologique :
Dosage de la Prolactine dans le sang :
Valeurs normales
- femme 20 à 30 ng/mL
- homme 10 à 20 ng/mL
Relation entre la taille de l’adénome et le taux de prolactine !
Attention :
- La Prolactine augmente au cours de la grossesse
- D’autres causes peuvent influer sur cette hormone (Oestrogène, TSH, Médicaments)
Anatomie : Souvent latéralisé au niveau de la glande, extension SUPRA SELLAIRE
Signal :
- Hyposignal T1
- Hyper signal T2
- Avec Gado , l’hypophyse saine se rehausse tandis que l’adénome reste en hyposignal T1
ACROMEGALIE= ADENOME à GH ( 15 %)
Anomalie de sécrétion d’hormone de croissance
Clinique : Déformation mains, pieds , visage, goitre de façon insidieuse. Diabète , HTA …
Biologique : Augmentation de la sécrétion de GH/ IGF1 et Prolactine possible
CONDUITS AUDITIFS INTERNES
Une explorations au niveau du rochers et de ces différents composants interviennent lors de : surdité, vertiges, acouphènes, paralysies faciales, otalgies isolées et traumatismes.
Rappels Anatomie
L’oreille est située à la partie latérale du crâne, dans une partie de l’os temporal appelée le rocher, sous le lobe temporal du cerveau dont elle est séparée par une coque osseuse.
Anatomiquement, on distingue 3 parties :
- l’oreille externe
- l’oreille moyenne
- l’oreille interne.
L’oreille externe comprend deux parties : le pavillon et le conduit auditif externe (CAE).
L’oreille moyenne est formée de cavités creusées dans le rocher (caisse du tympan et cellules mastoïdiennes) et aérées par la trompe d’Eustache qui débouche dans l’arrière nez appelé cavum ou rhino-pharynx.
Le tympan sépare l’oreille externe de l’oreille moyenne
Les osselets sont situés dans l’oreille moyenne
L’oreille interne (OI) ou labyrinthe comprend en fait 2 organes sensoriels : la cochlée pour l’audition et le vestibule pour l’équilibre.
Le labyrinthe membraneux donne naissance aux voies nerveuses acoustiques , nerf cochléaire et vestibulaires qui vont se réunir pour former la VIIIe paire crânienne (nerf auditif ou vestibulo cochléaire).
La cochlée est le siège de l’organe récepteur de l’audition
Le nerf auditif chemine dans le conduit auditif interne (CAI) et pénètre dans le tronc cérébral.
L’oreille externe comprend deux parties : le pavillon et le conduit auditif externe (CAE).
L’oreille moyenne est formée de cavités creusées dans le rocher (caisse du tympan et cellules mastoïdiennes) et aérées par la trompe d’Eustache qui débouche dans l’arrière-nez appelé cavum ou rhino-pharynx.
Le tympan sépare l’oreille externe de l’oreille moyenne
Les osselets sont situés dans l’oreille moyenne.
L’oreille interne (OI) ou labyrinthe comprend en fait 2 organes sensoriels : la cochlée pour l’audition et le vestibule pour l’équilibre.
Le labyrinthe membraneux donne naissance aux voies nerveuses acoustiques , nerf cochléaire et vestibulaires qui vont se réunir pour former la VIIIe paire crânienne (nerf auditif).
La cochlée est le siège de l’organe récepteur de l’audition.
Protocole explorations en IRM
- 3 plans Loca
- Sag T1 (TSE)
- Ax Diffusion
- Ax T2 Flair
- 3D T2 Haute résolution Ciss ou Fiesta sur les CAI
- 3D T1 gado
En complément : TOF ou ARM Angio pour études vaisseaux
CISS ou FIESTA
- Echo de gradient
- 3D avec reconstructions multi plans
- Limité au niveau de l’angle ponto cérébelleux
- Haute résolution spatiale
- Très bon contraste T2 , assez NOIR/BLANC
- LONG +++ 4 à 5 min
Bilan suite à des Acouphènes , vertiges ,une surdité brutale ou un hémispasme facial. Recherche de conflits vasculo-nerveux !
Pathologies fréquentes :
- Schwannome vestibulaire
- Anomalie vasculaire
- Choléstéatome
TUMEURS ET ONCOLOGIE
L’IRM est le gold standard pour la détection et le suivi des tumeurs cérébrales
- Nombreuses tumeurs intracrâniennes
- Diagnostic complexe et différent
- Traitement et survie différente
ATTENTION : Il faut distinguer les tumeurs primitives et secondaire ( métastase)
L’imagerie des tumeurs cérébrales a de nombreux objectifs :
- Détection de la lésion devant les premiers symptômes cliniques.
- Précision de topographie lésionnelle.
- Appréciation de la nature de la lésion.
- Synthèse des informations topographiques, morphologiques, métaboliques et fonctionnelles utiles afin d’approcher le type histologique et le grading de la lésion tumorale.
- Surveillance post-thérapeutique.
PROTOCOLE :
- 3 plans Loca
- Sag T1 (TSE)
- Ax Diffusion
- Ax T2 Flair
- Coro T2
- 3D T1 gado
En complément : PERFUSION et/ ou spectroscopie
Si bilan de métastases : Injection précoce après la diffusion afin d’obtenir une bonne imprégnation de celles-ci par le Gadolinium –> REPRODUCTIBILITE
Diffusion et ADC
Lors de l’exploration d’une tumeur, la diffusion et l’ADC sont deux données très importante:
Cela va nous renseigner :
- sur la densité cellulaire
- sur la viscosité
- sur la nécrose tumorale
- sur la démyélinisation
CLASSEMENT :
- METASTASES
- GLIOMES
- LYMPHOMES
- MENINGIOMES
- HEMANGIOME
- MEDULLOBLASTOMES
- NEURINOMES
METASTASES
Les métastases du SNC correspondent à une dissémination de tumeurs situées en dehors
de celui-ci et qui s’y étendent secondairement par voie hématogène.
Primitif : poumon, sein, reins, mélanome, tractus gastro- intestinal.
Primitif non retrouvé dans 10% des cas.
- 3 plans Loca
- Sag T1 (TSE)
- Ax Diffusion
- INJECTION
- SPACE FLAIR
- Coro T2
- SPACE T1 GADO
Les séquences SPACE ( 3TESLAS ) ont une meilleures sensibilité à la détection et prise de contraste métastatique.
Privilégier l’injection de GADOVIST, rehaussant beaucoup la prise de contraste.
- En T1, le signal est identique ou légèrement inférieur à celui de la substance grise.
- Un hyposignal s’observe si nécrose intra tumorale ou d’œdème périlésionnel.
- Un hypersignal traduit la présence d’hémorragie ou de mélanine.
- Hyper intense en FLAIR ET T2 par rapport à la substance grise
- Post injection de gadolinium: prise de contraste intense nodulaire ou en anneau, ou mixte
- Diffusion: ADC diminué. Il est augmenté dans les formes nécrotiques.
- Perfusion: rCBV élevé́ pouvant avoisiner celui des gliomes de haut grade.
- Il est abaissé dans la région péri tumorale métastatique contrairement à celui de la région péritumorale des gliomes de haut grade. (élément de diagnostic différentiel).
Du coté de la spectroscopie :
- Au sein de la lésion:
Augmentation du pic de choline, Absence de NAA.
Résonnance lipides/lactates en cas de nécrose.
- Au sein de l’hypersignal péritumoral:
Absence d’augmentation de la choline (critère permettant de différencier une métastase d’une lésion gliale infiltrant dont les aspects en IRM peuvent entré similaires).
GLIOMES
Les gliomes proviennent des cellules contenues dans le tissu de soutien du cerveau, la glie. Ils sont gradés de I (astrocytome pilocytique) à IV (gliome de haut grade). Ce sont les tumeurs les plus fréquentes du système nerveux central ( 42 %).
Les gliomes de grade I sont en général de très bon pronostic, alors que ceux de haut grade de type III et IV sont de mauvais pronostic avec une médiane de survie faible (un à trois ans)
Les gliomes de grade II , sont aussi appelées dans la littérature, GLIOME DE BAS GRADE.
Ce sont souvent des sujets jeunes inférieur à 50 ANS. Découvertes suite à une crise d’épilépsie, HTIC, Déficit, troubles cognitifs …
GRADE 1 :
- Astrocytome Pilocytique
- Tumeur la plus fréquente chez l’enfant
- Souvent localisé dans les zones hémisphériques ou en fosse cérébral postérieure
- Masse volumineuse, parfois kystique en partie
- HYPO T1
- HYPER T2
- Œdème Péri lésionnel peu marqué
- Variabilité prise de contraste.
Astrocytome Pilocytique
- Masse volumineuse, parfois kystique en partie
- HYPO T1
- HYPER T2
- Œdème Péri lésionnel peu marqué
- Variabilité prise de contraste.
GRADE 2 :
Important de les diagnostiquer précocement car , ils sont pendants longtemps asymptomatique mais une prise en charge précoce est essentiel pour la survie des patients.
- Rôle de l’IRM ++++
- Astrocytome de grade II
- Oligodendrogliome de grade II
- Oligoastrocytome de grade II
Astrocytome apparaît chez le sujet jeune ( 30 à 40 ANS)
- Region hémisphérique
- Zone fonctionnelle éloquente
Oligodendrogliome chez les 40-50 ANS
- Souvent dans le lobe Frontal
- Plus marqué chez les hommes
Oligoastrocytome = mixe des deux !
OLIGODENDROGLIOME
SIGNAL :
- HYPO T1
- HYPER T2 / FLAIR
- ADC peu modifié
- Prise de contraste minime ou absente
Contours réguliers
Remaniements kystiques ou hémorragiques
Œdème péri lésionnel modéré
Intérêt de la spectroscopie et perfusion :
Perfusion : rCBV augmenté jusqu’à 4
Spectroscopie : augmentation du pic de CHOLINE et baisse du NAA. Resonnance glutamine/ glutamate.
ASTROCYTOME DIFFUS
- 10-15% des astrocytomes.
- Adulte jeune
Siège: compartiment supratentoriel (lobes frontaux, pariétaux et temporaux) mais peuvent s’observer dans toutes les régions du SNC.
Hyposignal T1, en hypersignal T2 et FLAIR.
En diffusion, les gliomes de bas grade montrent peu de modification de l’ADC. Limites nettes dans 2/3 des cas, ailleurs floues et indistinctes.
Sous- cortical à l’origine, il infiltre la substance blanche en se développant en profondeur jusqu’aux ventricules, puis le cortex avec élargissement des structures anatomiques atteintes. L’œdème péritumoral est rare et en règle limité.
ASTROCYTOME DIFFUS
- 10-15% des astrocytomes.
- Adulte jeune
Siège: compartiment supratentoriel (lobes frontaux, pariétaux et temporaux) mais peuvent s’observer dans toutes les régions du SNC.
Hyposignal T1, en hypersignal T2 et FLAIR.
En diffusion, les gliomes de bas grade montrent peu de modification de l’ADC
Limites nettes dans 2/3 des cas, ailleurs floues et indistinctes.
Sous- cortical à l’origine, il infiltre la substance blanche en se développant en profondeur jusqu’aux ventricules, puis le cortex avec élargissement des structures anatomiques atteintes. L’œdème péritumoral est rare et en règle limité.
EPENDYMOME
12% des tumeurs gliales
Développées à partir des parois ventriculaires
Composantes solides :
- iso- ou hypo-intense par rapport à la substance blanche en T1
- hyper-intense par rapport à la substance blanche en T2
Hétérogène (lié à des remaniements (calcifications, nécrose, hémosidérine).
En diffusion, l’épendymome a un ADC discrètement augmenté.
En spectroscopie, les courbes montrent:
- Augmentation du pic de choline.
- Baisse du NAA.
- Elévation du pic de myoinositol
GRADE 3 haut grade :
ASTROCYTOME ANAPLASIQUE :
- Les astrocytomes anaplasiques peuvent soit survenir au cours de l’évolution des astrocytomes diffus de bas grade soit brutalement.
- L’âge moyen de survenue est de 45 à 50 ans.
Siège: prédominance sus tentorielle.
Masse infiltrant le cortex sus-jacent et s’étendant dans la substance blanche profonde vers les ventricules.
- Iso ou hypointense en pondération T1
- Hyperintense en pondération T2 et FLAIR.
- Prise de contraste variable.
Les hémorragies et les formations kystiques sont rares.
En diffusion, l’élévation de la cellularite lésionnelle tend a réduire l’ADC.
Les courbes de spectroscopie montrent:
- Élévation du pic de choline
- Baisse du pic de créatine et surtout du NAA
- Apparition d’une résonance de lipides et/ou de lactates
- La résonance du myoinositol s’effondre.
GRADE 4 : GLIOBLASTOME
- Le glioblastome représente 40% des tumeurs cérébrales primitives
- Il touche préférentiellement les adultes avec un pic de fréquence entre 45-75 ans, avec discrète prédominance masculine.
Siège: sus tentoriel.
- Masse de signal hétérogène en hyposignal T1
- Hypersignal T2 et FLAIR
- Prise de contraste hétérogène
- Remaniements hémorragiques (hyposignal T2*)
- En diffusion, les zones solides sont en hypersignal, en rapport avec un ADC bas.
Calcifications rares. Oedème Périlésionnel.
Les courbes de spectroscopie montrent :
- Elévation de la choline avec effondrement de NAA
- Absence de pic de myoinositol
- Apparition de résonance de lactates/ lipides, témoins respectifs de l’anabolisme tumoral et de la nécrose.
LYMPHOMES
Le lymphome primitif du système nerveux central (LPSNC) est un type de lymphome non
hodgkinien (LNH) qui prend naissance dans le cerveau ou la moelle épinière (système
nerveux central, ou SNC). La plupart des lymphomes primitifs du SNC sont de type B.
Les lymphomes cérébraux primitifs sont rencontrés chez les patients immunodéficients
Rare , 3 à 5 % des tumeurs cérébrales
Moyenne d’âge 35 ans
Les masses tumorales sont le plus souvent situées centralement: noyaux gris de la base, région périventriculaire et corps calleux.
Ces effets de masse sont généralement bien délimités, mais ils peuvent avoir un caractère infiltratif.
Repérage :
- Iso ou Hypo T1
- Iso ou Hypo T2/ FLAIR
- Forte prise de contraste
- Œdème modéré
- Hyper signal diffusion et ADC abaissé (forte cellularité)
- Absence d’hyper perfusion
- Retour de la courbe au dessus de la ligne de base = Rupture de la Barrière HématoEncéphalique
Méningiomes
- Age moyen : 50 ANS
- Prédominance féminine
Classification de L’ OMS en 3 grades :
Grade I, Classique: 84%
- Méningothélial
- Psammomateux
- Fibroblastique
- Kystique
- Transitionnel
- Endothélial
Grade II, Atypique : 11%
- Anaplasique
- À cellules claires
Grade III, Malin: (5 %).
Signal :
- Hypo signal T1
- Iso T2 au cortex cérébral: 50%,
- Hyper T2 : 50 %
- Rehaussement intense et homogène
SCLEROSE EN PLAQUES
La SEP est une pathologie inflammatoire chronique du SNC caractérisée par une destruction des gaines de myéline par plaques, disséminées dans l’espace et le temps. Les zones de démyélinisation peuvent également affecter la substance grise, en particulier corticale.
Décrite vers 1870 par le Professeur Charcot
L’inflammation est majoritairement sous la médiation des lymphocytes T en particulier CD4 et CD8
La SEP n’a pas de marqueur biologique permettant un diagnostic certain. Celui-ci repose sur un ensemble d’éléments cliniques, biologiques et radiologiques.
Ils ont été décrits par Barkhof en 1997, revus par Mac Donald en 2005 prenant d’avantage en compte les lésions médullaires.
- 2 millions de personnes touchés dans le monde !
- Adulte jeune 20 à 40 ans
CLINIQUE :
Les manifestations cliniques de la SEP sont diverses et, à un moment ou un autre, on peut
observer l’un des symptômes suivants ou une quelconque combinaison :
- des troubles visuels , une diplopie (vision double), une atteinte multiple des nerfs crâniens.
- des troubles moteurs.
- des troubles de la sensibilité (fourmillements, douleurs).
- des troubles sphinctériens
Classiquement, la sclérose en plaque est une maladie de l’adulte jeune, caractérisée par des poussées suivies de rémissions. Toutefois, on notera qu’il existe des formes d’emblée progressive.
Le diagnostic se pose en fonction de la clinique du patient :
- Notion de DISSEMINATION TEMPORELLE
Signes cliniques qui vont apparaitre dans le temps et / ou régresser dans le temps.
- Notion de DISSEMINATION SPATIALE :
Lors d’une seconde phase , il faut que les signes cliniques soit différent
PROTOCOLE :
- LOCA
- SAG T2 TSE
- AX DIFF OU RESOLVE
- AX T1
- Injection
- SPACE OU CUBE FLAIR
- 3D GADO
- EN OPTION : AX T2 FIN 2MM sur la fosse postérieure
Les Hypersignaux T2 sont particuliers car ils sont supérieur à 3mm
Formes particulières :
- Ovoïdes ou arrondies
- Perpendiculaire aux ventricules
- Doigt de DAWSON
Localisation :
- Périventriculaires
- Corps Calleux
- Pédoncule cérébelleux moyens
- Cornes temporales
- Nerfs optiques
ISO OU HYPOSIGNAL T1
- Trous noirs appelées BLACK HOLES
- Association de lésions prenant ou non le gadolinium
GADOLINIUM :
- Marqueurs de l’inflammation active
- Présent surtout au début de la maladie
- Durée inférieur à 3 mois (crise)
Type :
- Nodulaire
- Annulaire
- En C
Explorations médullaires :
- Prévalence au niveau cervicales
- Doivent être inférieur à 2 corps vertébraux
- Postéro latéral sur les coupes axiales
DEMENCES
Les trouble cognitif reposent sur la détérioration des processus mentaux de la
mémoire, du jugement, de la compréhension, et du raisonnement.
Le but de l’IRM dans ces tableaux cliniques est :
- D’ éliminer une cause curable ou un diagnostic différentiel(Hématome , Ischémie, Oncologie…)
- Affiner le diagnostic et préciser le type de démence
Etude spécifique des lobes temporaux et des Hyppocampes (joue un rôle central dans la mémoire et la navigation spatiale).
PROTOCOLE :
- SANS INJECTION
- Loca
- AX DIFF OU RESOLVE
- AX FLAIR
- 3D T1 SANS GADO
- AX T2* OU SWI
- CORO T2 SPECIAL ETUDE HYPOCAMPES
ROLE DU MANIPULATEUR ++++
- Les coupes CORONALES doivent orientés
- De façon perpendiculaire au lobe temporal.
- Les reconstructions du volume T1 de la même façon.
- Cela nous permet de se mettre dans le plan
- Hyppocampique et de faciliter leurs études.
Par étapes :
- Etude vasculaire dans un premier temps : recherche de Micro Bleeds sur le T2*
- Recherche de Leucopathie : ( dégénérescence de la substance blanche au niveau des Artères profondes)
- Anomalies précurseurs dans les démences liés aux vieillissement : HYPERSIGNAUX FLAIR (3 stades)
Maladie D’ALZHEIMER
- Atteinte de la mémoire épisodique
- Atrophie Hypoccampique
- Présence Protéines TAU et AB 42 dans le LCR
- Anomalie génétique familiale
Démence à CORPS DE LEWY
- 2ème cause de démence
- Fluctuations cognitives
- Hallucinations visuelles
- Syndrome Parkisonien
Structures touchées :
- régions limbiques,
- néocortex
- structures sous-corticales
PATHOLOGIES INFECTIEUSES
Abcès Cérebraux
- Symptomatologie non spécifique
- Céphalées / nausée / troubles de la conscience
- Perturbation du LCR
- Origine suite à une infection (dentaire , otite…) , hématogène, suite d’une neurochirurgie
LOCALISATION : Frontale et Temporale +++
PROTOCOLE
- LOCA
- AX DIFFUSION OU RESOLVE
- AX FLAIR
- CORO T2
- AX T2* OU SWI
- T1 GADO 3D
- Compléments : Perfusion et/ ou spéctrométrie
Encéphalite Herpétique
Des hypersignaux en séquence T2, en diffusion et en FLAIR sont visibles dès les premières 48 heures d’évolution.
Les structures préférentiellement touchées sont les lobes frontaux et temporaux. Les lésions sont unilatérales dans près de la moitié de cas.
PROTOCOLE
- LOCA
- SAG T1
- AX FLAIR
- CORO FLAIR
- CORO T2
- AX T2*
- 3D GADO
Signal :
- Parfois Hyper signal T1
- Parfois Hyper signal Diffusion
- Prise de contraste
- Visibilité de petits remaniements hémorragique sur le T2*
La maladie de CREUTZFELD JACOB
La maladie de Creutzfeldt Jacob est une affection neuro- dégénérative rare, due à l’accumulation dans le SNC de protéines infectieuses nommé prions.
Clinique :
- trouble de l’équilibre
- confusion mentale avec propos délirants
- agitation, des mouvements brusque des mains et d’une rigidité généralisée.
IRM : Hyper Signaux flair et Diffusion au niveau des noyaux gris et des thalamus
Leucoencéphalopathie postérieure réversible ou PRES
Posterior-reversible encephalopathy syndrom
La leucoencéphalopathie postérieure réversible est généralement une complication rare d’une élévation brutale de la pression artérielle survenant chez un patient chroniquement hypertendu
CLINIQUE
- Ralentissement psychomoteur
- céphalées inhabituelles
- Une confusion
- Des nausées et vomissements
- Troubles visuels
FACTEURS FAVORISANT
- Hypertensionartérielle
- Toxémie gravidique
- Insuffisance rénale
- Traitements immuno suppresseurse et anticancéreux
Signal :
- Hyper signaux T2 ou flair
- Hyper signal diffusion car œdème
- Pas de prise de contraste
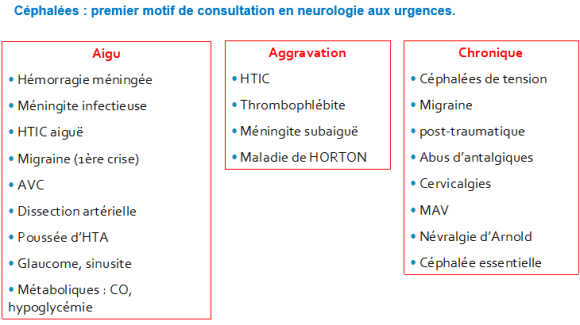
CEPHALEES
Céphalées : Besoin d’un examen clinique complet et clair car il existe de nombreuses différences dans les céphalées.
Il faut rechercher l’intensité, le siège, la fréquence, le mode d’apparition, horaire, la réponse aux traitements), les symptômes et signes associés.
On distingue les céphalées PRIMAIRES :
- Migraines.
• Céphalées de tension.
• Algie vasculaire de la face.
• Céphalées en coup de poignard.
• Céphalées déclenchées par le froid.
• Céphalées de la toux.
• Céphalées bénignes d’effort.
• Céphalées liées à l’activité sexuelle.
• Céphalées hypniques.
• Hemicrania continua. - Céphalées récentes quotidiennes persistantes.
On distingue les céphalées SECONDAIRES :
- Céphalées post-traumatiques
- Cause vasculaire
- Infection ou inflammation méningée
- Cause intracrânienne non vasculaire : hypotension intracrânienne : HTIC.
- Trouble de l’homéostasie : hypoxie, hypercapnie, HTA
- Cause toxique ou de sevrage
- Troubles psychiatriques : dépression, etc.
- Algies faciales (cou, yeux, nez, sinus, dents…)
- Névralgie crânienne, autre cause centrale de douleur faciale.

Le Scanner Sans IV est le Gold standard en première intention complété par une angiographie du polygone de Willis.
Il est complété par une ponction lombaire bien souvent, nous renseignant sur la présence de sang dans le LCR, méningite, hypertension du LCR….
L’IRM possède néanmoins plusieurs avantages :
- Diagnostic pathologies vasculaires plus faciles
- Possibilité d’avoir une angiographie sans produit de contraste
- Oriente plus rapidement le diagnostic dès les premières séquences
MALADIE DE HORTON
- Sujet âgé ( plus de 70 ANS )
- Vascularite des moyens et gros vaisseaux
- Prédomine dans le territoire de l’artère temporale
Signes cliniques généraux :
- Perte de poids
- Fièvre, 39-40°
- Anorexie
Signes cliniques spécifiques du syndrome de l’artère temporale
- Artère temporale indurée
- Perte de la palpation du pouls temporal
- Claudication intermittente de la mâchoire
- Hyperesthésie du cuir chevelu
- Nécrose de la langue
Le plus grand risque de cet pathologie est l’atteinte oculaire
- Douloureuse
- Peut être irréversibles
Traitement rapide : cortico thérapie + anticoagulation + anti agrégeant plaquettaires
IMAGERIE :
- Hypersignal T2 provoqué par l’œdème péri artérielle
- Hyper T1 GADO