La gamma caméra d’ANGER
Caméra la plus utilisée dans les services avec les TEP SCAN. Décrite par Hal ANGER en 1957. Il y a possibilité d’obtenir des images dynamiques. Translation et/ou rotation possible suivant les appareils. Il y a le plus souvent 2 détecteurs.
Principe : Administration d’une molécule radioactive. Les rayons gamma issus du patient traversent le collimateur et se transforment en lumière dans le cristal. Ces photons lumineux se dirigent ensuite vers les photomultiplicateurs (PM) et sont transformés en impulsions électriques. Ces impulsions sont analysées pour former une image.
Les têtes détectrices (PM + cristal) sont plombées pour éviter une interférence avec les rayonnements extérieurs.
Collimateurs
Plusieurs types de collimateur (zone blanche) :
- A lames parallèles
- En éventail (fan-beam)
- Sténopé (cône en plomb)
Principe : Sélection des photons incidents en fonction de leur direction. Ils assurent ainsi la correspondance entre chaque point objet et son point image homologue.
Le choix du collimateur influe sur la résolution spatiale et le champ de vision du détecteur.
Le collimateur parallèle
C’est une galette en plomb où il y a des sections de canaux circulaires ou hexagonales.
- Alternance : canal (ou trou) + septa (épaisseur de plan entre deux trous)
Sélectionne les photons perpendiculaires au cristal (les septas arrêtent les rayons ayant une trajectoire oblique).
L’épaisseur de plomb calculée pour obtenir une atténuation d’au moins 95% des rayons obliques franchissant les septas. Donc l’épaisseur des septas est adaptée à l’énergie du radio-isotope étudié (collimateurs basse, moyenne et haute énergie). (Voir image 3)
Ex : LEHR ou BEHR (Basse énergie, Haute résolution)
- Longueur des canaux plus élevée pour les collimateurs haute énergie.
Plusieurs collimateurs parallèles sont disponibles pour une même caméra. Choix en fonction de l’énergie du radioélément, de la résolution spatiale et la sensibilité.
Ex : collimateur basse énergie/ haute résolution spatiale / basse sensibilité.
Avantages :
- Images de taille réelle et non inversée
- Champ d’exploration de la taille du cristal
- Pas de déformation de l’image
Inconvénients :
- Mauvais « zoom » sur les organes
- Dégradation de la résolution spatiale proportionnelle à la distance patient/collimateur.
Il faut s’approcher au maximum lorsqu’on utilise ce type de collimateur.
Le collimateur pinhole (ou sténopé)
C’est un cône en plomb. L’image obtenue est inversée (droite et gauche ; haut et bas). Il y aura un retraitement informatique.
Meilleur résolution spatiale que sur un collimateur parallèle. Il y a un intérêt pour les organes de petite taille (thyroïde ou hanche de bébé…). On peut obtenir un agrandissement variable avec la distance collimateur/source.
Si on veut un agrandissement il faudra rapprocher l’organe. Si on veut un rétrécissement il faudra éloigner l’organe.
Le collimateur FAN BEAM (ou éventail)
Adapté aux cerveaux. Collimation convergente dans une direction. Il y a un point de convergence qui sera l’emplacement de l’organe à voir.
Meilleure résolution spatiale par rapport à un collimateur parallèle.
Agrandissement mais distorsion géométrique à Il y aura des reconstructions informatiques grâce à des algorithmes.
Il y a un côté où les canaux sont parallèle et l’autre où ils convergent vers un point.
Caractéristique d’un collimateur
La sensibilité (ou efficacité géométrique) :
Rapport nombre de photons transmis / nombre de photons émis
Capacité à laisser passer des photons. Plus il est sensible, plus il laisse passer de photons.
Elle s’améliore avec :
- L’augmentation du diamètre des canaux
- La diminution de la profondeur des canaux
La résolution spatiale :
Aptitude à séparer deux sources ponctuelles rapprochées.
Elle s’améliore avec :
- La diminution de la taille des canaux
- L’augmentation de la profondeur des canaux
La sensibilité varie en sens inverse de la résolution spatiale
Critères de choix des collimateurs :
En fonction de l’organe étudié :
- Os : parallèle
- Cerveau : Fan Beam
- Hanches bébés, thyroïde : pinhole
En fonction du radioélément :
- Basse énergie
- Moyenne énergie (pour collimateur parallèle)
- Haute énergie
Compromis résolution spatiale/sensibilité :
- Collimateurs parallèles haute résolution spatiale et basse énergie
- Basse énergie et haute sensibilité
Cristal
Stoppe les photons Gamma issus du radioélément et les convertit en photons lumineux de fluorescence.
Cristal d’iodure de sodium activé au thallium (Na TL).
Les impuretés de Thallium permettent une émission de photons ayant une longueur d’onde « visible » par les photomultiplicateurs.
Les cristaux sont des matériaux très fragiles et très sensibles aux variations de température.
Hygroscopique (absorbe l’humidité de l’air) et donc enfermé hermétiquement dans une couche d’aluminium (sauf coté PM).
Diamètre : environ 50 à 70 cm.
Epaisseur : de 6.25 à 13 mm.
Z élevé pour favorisé l’effet photo-électrique (évite l’effet Compton, donc le rayon diffusé).
Masse volumique élevée pour un fort pouvoir d’absorption.
La face de sortie est recouverte par une lame de verre couplée aux PM et des joints optiques (guide de lumière)
L’efficacité de détection dépend de l’énergie du photon incident pour la même épaisseur de cristal (Ex : 100% à 100 KeV et 22% à 360 KeV).
La majorité des photons absorbés par effet photoélectrique.
- Toute l’énergie du photoélectron est déposée au voisinage immédiat du point d’interaction.
La diffusion Compton, seule une partie de l’énergie du photon est déposée au voisinage immédiat du point d’interaction.
- Le photon diffusé peut créer plusieurs sites d’émission lumineuse ou d’échapper du cristal.
Le nombre de photons lumineux reçus par les PM est proportionnel à l’énergie déposée dans le cristal par les photons Gamma
- Plus le cristal est épais plus la localisation est imprécise = résolution spatiale.
- Plus le cristal est mince, moins bonne est la sensibilité.
Guide de lumière
Rôle : éviter la réflexion des photons en sortie de cristal (indice de réfraction cristal et air différent).
Quand la lumière sort droite à va droit vers le photomultiplicateur.
Photomultiplicateur
Convertit les photons lumineux qui proviennent du cristal en signal électrique (impulsion électrique) permettant de localiser les photons gamma issu du patient.
- Environs 100 photomultiplicateur dans une caméra
- Forme ronde ou hexagonale
Photomultiplicateur : tube à vide dans lequel on applique une différence de potentiel. Les photons lumineux qui arrivent sur la photocathode qui elle, émet des photoélectrons par effet photoélectrique. La différence de potentiel augmente à chaque dynode (circuit Haute Tension). Chaque dynode frappée par un électron restitue un ou généralement plus d’électrons.
Système de localisation des photons
A chaque scintillateur, l’ensemble des impulsions électrique est délivrée par les photomultiplicateurs jusqu’au calculateur de positionnement.
Les signaux sont directement numérisés en sortie des photomultiplicateurs (sur dernières caméras).
Le circuit de positionnement analyse la distribution de l’amplitude des signaux délivrés par les photomultiplicateurs et fournit les coordonnées du point d’interaction dans le cristal.
En sortie du photomultiplicateur à 2 coordonnées X et Y ; ainsi qu’une amplitude électrique Z.
Analyseur et sélecteur d’amplitude
L’ensemble Z de tous les signaux de sortie des photomultiplicateurs est proportionnelle à l’énergie perdue dans le scintillateur et donc à l’énergie du photon incident absorbé dans le cristal.
L’impulsion Z est amplifiée. Il y a sélection de l’impulsion Z participant à la formation de l’image grâce au sélecteur d’amplitude.
L’électronique
Amplificateur : circuit électrique qui augmente l’amplitude des impulsions où le gain peut être contrôlé.
Sélecteur d’amplitude
Compteur d’impulsion :
- 2 circuits électriques permettent de travailler en pré-temps et/ou en pré-coups:
- Circuits de comptage
- Horloge
En pré-coups : choix du nombre de coups. Une fois la valeur X de coups choisis atteint le système s’arrête.
En pré-temps : choix du temps. Une fois le temps écoulé, le système s’arrête.
Les deux : système qui ne s’arrête pas temps que le temps est non écoulé et pré-coups non atteint.
SCHEMA RECAPITULATIF DU SYSTEME DE GAMMA CAMERA
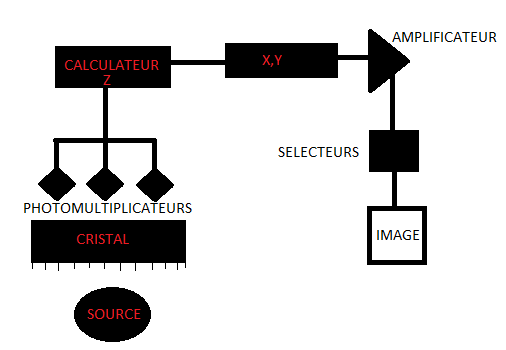
Caractéristiques d’une gammacaméra
Résolution spatiale du détecteur
Définition : plus petite distance séparant 2 sources ponctuelles radioactives.
- Environs 7 à 9 mm.
- D’autant meilleure que cristal est mince.
La résolution spatiale est limitée par le collimateur !
- Résolution intrinsèque : cristal + électronique à qualité image mesurée sans collimateur
- Résolution extrinsèque : qualité image mesurée avec collimateur
La résolution spatiale est la mesure de la largeur à mi-hauteur d’un profil d’activité obtenue à partir de l’image d’un point. (Voir image 9)
- Plus la courbe est fine, plus la résolution spatiale est élevée.
- Plus on est au centre de la source, plus il y a d’activité maximum.
- Plus on s’éloigne de la source, moins la courbe sera haute (décroissance courbe).
Résolution en énergie
Définition : capacité de distinguer les photons gamma selon leur énergie et de séparer le pic d’absorption du diffusé.
C’est le rapport de la largeur à mi-hauteur (moitié du nombre d’évènements maximums) et de l’énergie Ei des photons incidents.
(Environ 10% à 140 keV). Energie de rayonnement incident.
Quand il y a une mauvaise résolution en énergie la courbe est très élargie.
- Le plus faible possible pour meilleure Résolution en énergie.
Taux de comptage maximal
Définition : capacité à compter le plus grand nombre de photons.
- Dépend du temps mort (temps pendant lequel l’évènement est comptabilisé = une seule détection pouvant être enregistrée à la fois).
- Taux de comptage actuel > 300 000 impulsions par secondes.
Le taux de comptage est d’autant plus faible que le temps mort est fort et que le phénomène d’empilement est fort (pour deux informations qui arrivent en même temps, elles sont rejetées).
Uniformité
Définition : aptitude de la caméra à fournir une image homogène pendant qu’elle est soumise à une source radioactive uniforme.
- Elle est d’autant meilleure que :
- L’écart de gain entre les photomultiplicateurs est faible.
- Correction d’homogénéité efficace (=table informatique).
Utilisation de matrices de correction pour corriger les défauts d’uniformités (et linéarités géométriques). Calibration des photomultiplicateurs pour chaque élément radioactif.
Linéarité géométrique
Définition : capacité de la caméra à déterminer précisément les coordonnées de l’interaction du photon gamma dans le cristal.
Une source linéaire formant normalement une ligne ne doit pas apparaitre déformée au niveau de l’image.
Différents types d’acquisition
Acquisition statiques
- Détecteur en position fixe
- Image obtenue représente la distribution radioactive d’un organe.
Distribution : répartition du produit injecté dans un organe ciblé.
- Plus incidences sont généralement demandées pour obtenir différentes « vues » de l’organe étudié. Ex : face antérieur, face postérieur…
Bien distinguer la face antérieur et postérieur car image totalement différente à cause de la masse de tissu importante à traverser selon la position.
- Caractéristiques d’une image :
- Acquisition en pré temps (ex : 5min) ou en pré coups (nb de coups formant l’image ex : 200 Kcps), variable en fonction du rapport signal sur bruit. On peut aussi associée les deux paramètres et lorsque le premier est atteint la machine se coupe.
- Matrice (l’image est découpée en lignes et colonnes et forme une grille où chaque élément (ou pixel) représente un empilement d’impulsion). Ex : 64², 128².
Plus la matrice augmente, plus la RS (résolution spatiale) est importante mais plus le signal par pixel diminue.
Profondeur des pixels (valeur maximale pour un octet : de 0 à 255) qui dépend de la quantité d’information dans chaque pixel. Plus la profondeur du pixel est grande plus la capacité de stockage d’information est grande.
Ex : scintigraphie pulmonaire avec injection en perfusion ou en aérosol.
Acquisitions synchronisées (avec l’ECG)
Examens couplés à l’ECG. (Voir image 12)
Un cycle cardiaque est découpé en x période (8, 16…). Au premier cycle cardiaque, x images sont réalisées. Au deuxième cycle, x autre images sont aussi réalisées et additionnées aux précédentes et ainsi de suite.
Ex : information avec le ventricule gauche avec les battements cardiaques.
Fenêtre d’acceptation des battements cardiaques en fonction de la fréquence cardiaque. On lance à blanc l’acquisition pour repérer les cycles cardiaque du patient. Et ensuite on ne prend que les cycles à l’intérieur d’une fenêtre (RR). Graphique = Nombre de cycle en fonction de la durée du cycle.
On détermine un ROI et on compte le nombre d’information à l’intérieur.
Fraction déjection ventriculaire (61%). On peut déterminer ce seuil, et c’est ce qui est cherché suite à une chimiothérapie.
Acquisitions dynamiques
Succession d’images qui démarre à l’injection.
- Intérêt : suivre l’arrivée des produits radioactifs en fonction du temps. Surtout dans les articulations. Ex : pied et cheville.
- On met en évidence un procédé physiologique.
- Caractéristiques : idem statiques avec en plus :
- Temps de chaque image (ex : 5s)
- Temps total de l’acquisition
- Nombre d’images
On peut utiliser ce type de procédé pour faire une scintigraphie rénale.
Balayage corps entier
Balayage de la tête aux pieds
Réalisations simultanées de 2 incidences (face antérieure, face postérieure)
Dure environs 15 minutes et on voit apparaitre le squelette.
Idem statiques + vitesse balayage en cm/min + longueur du balayage (cm)
Une fois que les hyperfixations sont symétriques c’est qu’il n’y a pas de pathologies.
Tomographie d’émission monophotonique (SPECT)
Intérêt : grâce à une rotation des têtes autour du patient, on obtient une reconstruction en 3D de la distribution radioactive d’un organe. On peut éviter la superposition de certaines structures (cœur et foie notamment).
- Les têtes sont montées sur un axe.
- Angulations par pas de x degrés.
- Angulation sur 90 à 360 degrés.
- A chaque rotation, acquisition d’une image.
On n’a que 10% du produit qui se retrouve dans le cœur pour une scintigraphie myocardique.
- Caractéristiques : idem statique avec en plus :
- Nombre de projections
- Durée de chaque projection
- Angle de rotation
- Position de départ (O° si les deux commencent au-dessus du patient, si les deux détecteurs se retrouve en face elle est dit en « H », si ils sont à 90° de différence elle est dite en « L »)
- Orientation des détecteurs
L’acquisition 3D, à partir de l’ensemble des projections réalisées est ensuite reconstruite par informatique.
Faire attention à la distance entre le patient et le collimateur (dégradation de la RS).
- Rapprocher les collimateurs au maximum.
Possibilité de synchroniser avec l’ECG (répartition de la radioactivité au cours d’un cycle cardiaque).





